在生命科學還未曾興起的時代,人類對跨物種生命體的想象只停留在麒麟、美人魚這類形象。如今,隨著科學技術的發展,物種間界限的突破不再是天方夜譚,組合物種的功能也不再是遙不可及的事情。

經過改造,微生物能擁有來源于動物、植物等生命體的能力
(圖片來源:Wikipedia及Veer圖庫)
想要將一個物種的功能在另一個物種中完美呈現,把來源于不同物種,代表不同功能的DNA組裝起來是實現最終目標的第一步。實現這個過程的技術叫做“DNA組裝”的技術,它從無到有,從繁至簡的過程離不開一群才華卓越的科學家和生物工程師。
歷經半個多世紀,“DNA組裝”的玩法趨于豐富。從場所來分,“DNA組裝”可以分成體內和體外兩種,我們首先來了解下體外組裝技術創造者背后的故事。
在第一種DNA組裝技術誕生之前,如果說生命體是大自然天衣無縫的作品,那么第一種DNA組裝技術的誕生便賦予了生物工程師“上帝視角”和部分“造物”能力——“上帝視角”讓生命體的生物學功能在工程師眼中變成可供組裝的模塊,“造物”能力則賦予工程師組裝模塊的能力。由此,生命體的表型形式也隨著人類的想象力打開了新的圖景。
1973年,物種間邊界第一次被打破。在這一被視為遺傳工程的開山之作中,斯坦福大學的斯坦利·諾曼·科恩(Stanley Norman Cohen)教授和加州大學舊金山分校的赫伯特·韋恩·博耶(Herbert Wayne Boyer)教授是最關鍵的兩位生物工程師。他們的石破天驚之舉,是首次在體外將一個生命體的DNA片段和一個質粒連接起來,在形成重組質粒之后,將其轉到另一個生命體。此時,原生命體DNA所代表的生物學功能得到完美的復制。

斯坦利·諾曼·科恩和赫伯特·韋恩·博耶
(圖片來源:維基百科)
這種在現在看來可能平平無奇的DNA組裝技術就是酶切連接,在技術中發揮關鍵作用的主要是限制性內切酶和DNA連接酶。(是不是喚醒你沉睡的高中記憶?)限制性內切酶就像剪刀,能識別并切割特定DNA序列,且在切割不同來源DNA后,其留下來的缺口一致。這樣,不同切割產物上形成的切口就可以通過堿基互補配對跟彼此粘連在一起。
那DNA連接酶能發揮什么作用呢?DNA連接酶如同膠水一般,可以將兩個片段間的缺口連起來,形成完整的DNA雙鏈。雖然DNA識別位點的特異性對這種技術造成了限制,但截止目前,超過800種已經商業化的限制性內切酶還是極大增加了工程師的選擇。
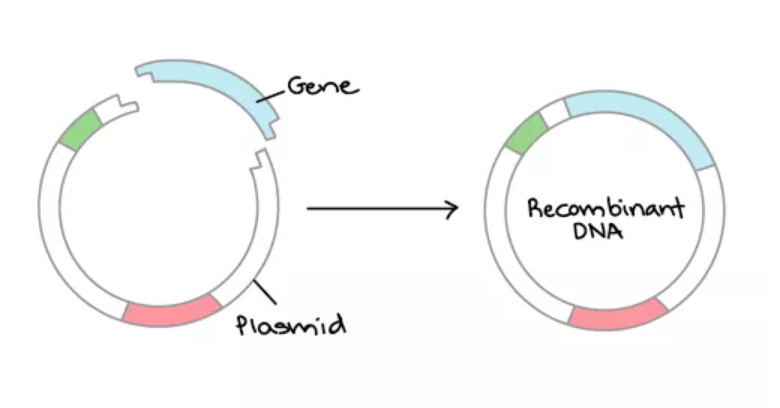
酶切連接(圖片來源:Khan Academy)
尊重創造的制度及文化氛圍從不虧待那些聰明絕頂的想法,與革命性技術相匹配的應當是締造者的名利雙收。因為這項技術的發明,兩位發明人以及他們所屬的機構獲得了豐厚的回報,在申請3項專利之后,曾有超過470家公司有償使用過它們,專利本身也影響了數千種產品的開發。功不唐捐,兩人共同分享了包括“拉斯克基礎醫學研究獎”、“國家技術獎章”、“邵逸夫獎”等眾多分量十足的獎項。
在生物技術的圖譜中,有些技術的誕生是水到渠成。當基礎研究的成果積累到一定程度時,一個神來之筆便會促進新技術的蓬勃發展,2020年獲得諾貝爾化學獎的CRISPR基因編輯便屬于此類。但還有一些技術的發明,是由宏大的目標所催生的。
人工合成細胞是21世紀之初的一個宏愿,這個項目的共同領導人是漢密爾頓·史密斯(Hamilton O Smith),克萊德·哈奇森(Clyde A Hutchison III)和克雷格·文特(J Craig Venter)教授。人工合成一個583kb(kb即kilobase,千堿基對)的支原體基因組則是他們所面對的一個具體的挑戰,這個挑戰最終催生的技術叫做吉布森組裝(也叫Gibson組裝,Gibson是這個技術主要發明人Daniel G Gibson的姓)。

丹尼爾·吉布森,克雷格·文特,克萊德·哈奇森,漢密爾頓·史密斯(圖片來源:The J. Craig Venter Institute)
在常規的酶切連接中,不同片段之間的連接依賴的是片段之間一致的酶切位點,這對于目標長度較小、應用較為簡單的DNA組裝任務基本夠用。但是,在面對目標產物較長,較為復雜的DNA組裝任務時,限制性內切酶的有限性及酶切位點的特異性使得這種方法顯得無能為力。
Gibson組裝擺脫了酶切連接的限制,基本能做到“包打天下”——任意兩個DNA片段,只要末端有一定長度重疊的序列,兩個片段就可以被組裝起來。此外,其能組裝起來的DNA也遠大于酶切連接組裝起來的DNA序列。
在Gibson組裝中,出力的主要是三種酶:T5核酸外切酶、高保真DNA聚合酶與Taq連接酶。首先是T5核酸外切酶,它能從DNA的5’到3’端逐個切除堿基,使DNA的末端變成單鏈。由于兩個需要組裝的DNA片段之間有重疊,所以兩個末端的單鏈又能通過堿基互補配對連接起來。此時的連接產物仍不完整,缺乏的堿基會由高保真的DNA聚合酶補上,兩個片段之間最后的間隔則由連接酶來連接。
經由這一過程,他們最初開發這個技術的目標得到實現,甚至900kb左右乃至更高千堿基對的DNA片段也可以用這種技術組裝起來。
Gibson組裝(圖片來源:翻譯自Daniel G Gibson et al., 2009)注:紅色和綠色代表不同的DNA片段,黑色代表兩個片段間一致的序列
鑒于Gibson 組裝的高效、普適,以及其在大片段DNA組裝能力方面的一騎絕塵,被開發出來之后,它很快地受到了科學界和工業界的廣泛關注和認可。一個典型的表現是,2009年開發此技術的文章目前已經被學術界的同行引用超過6000次。另外,基于Gibson 組裝的試劑盒以及可以自動組裝DNA的儀器都已被制造出來,成為一種商品,Gibson組裝也成為目前主流的DNA組裝方法之一。其得到普及的一大重要原因是,改進后的Gibson組裝技術,還能幫著省錢。
盡管從能實現的組裝任務上來看,Gibson組裝基本上可以算得上一種終極的解決方案了。但是從部分使用者的角度出發,這一技術卻有一個不好意思說的缺點——價格太貴。購買商業化的試劑盒,進行一次DNA組裝,平均下來就要100來塊錢。用的次數少還好,如果需要組裝的DNA過多,那么對于一些經費捉襟見肘的實驗室而言,便是不可忽視的壓力。
Gibson使用了3個酶,為了給同行省錢,也為了在DNA組裝的市場里分一杯羹,不少生物工程師在減少酶的種類上花了不少心思。比如,一些只使用一個酶的DNA組裝技術已經被開發出來了。其中最便宜的一種是由中國學者所開發的,這種方法叫做T5核酸外切酶依賴的組裝(TEDA:The T5 exonuclease-dependent assembly)。顧名思義,在這種“玩法”中,扮演最為關鍵角色的酶是T5核酸外切酶。
T5核酸外切酶依賴的組裝(Yongzhen Xia et al., 2018)
TEDA組裝同樣需要被組裝的DNA片段末端存在15bp(bp即base pair,堿基對)以上的重疊區域,步驟總共分為三步。前兩步和Gibson組裝一致,都是通過T5核酸外切酶的切割以及片段間的自配對形成一個不完整的中間體。
區別在于第三步,在這個方法中,中間體直接被轉到大腸桿菌體內,由大腸桿菌代勞,把缺口補上連接好,承擔省錢的重任。
除以上三種比較有代表性的、涉及到體外的DNA組裝技術,還有兩種可以直接在微生物體內組裝DNA的技術同樣值得說道。
第一種影響力比較大的體內組裝技術叫做RecET重組技術,這種技術的發明和推廣和一位中國學者有著非常密切的關聯,現山東大學的張友明教授和他曾經的博士后合作導師弗朗西斯·斯圖爾特(A. Francis Stewart)是該技術主要的共同發明人。

張友明和弗朗西斯·斯圖爾特(China daily 和Francis Stewart group)
這也是一種原理看起來極致簡潔的DNA組裝技術,其主要基于大腸桿菌E.coil進行開發的。它的特點是能利用一個線性化的載體捕獲幾乎任何類型的DNA,不管捕獲的對象是DNA片段、質粒還是E.coil的基因組,只要線性化的載體兩端和要捕獲DNA兩端有一致的序列,把它們一起轉到E.coil中,它們基本就可以被組裝起來。
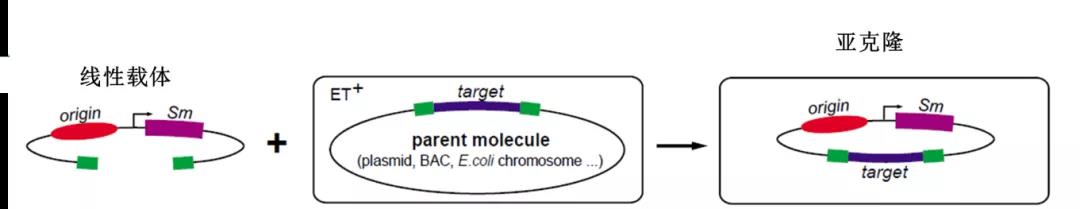
RecET重組示意圖
(圖片來源:Youming Zhang et al., 2000)
當然,這種E.coil不是一般的E.coil。它的特殊之處在于,它是從“死對頭”噬菌體借用了三個關鍵的蛋白:最初來自噬菌體的RecE(5’-3’核酸外切酶)、RecT(單鏈DNA結合蛋白)還有Redγ(一個抑制線性DNA片段被降解的蛋白)。
實際上,將病毒來源基因或者酶應用到生物技術的開發上,RecET重組并不是孤例,生物學家的工具包里還有很多工具同樣都是病毒的饋贈。(而這些故事,我們則留至后續的文章中再細細道來)
所有重要的生物技術,都具有巨大的商業價值。RecET重組技術的歷程再次證明了這一點。在該技術誕生兩年之后,為拓寬該項技術的應用,作為發明人之一的張友明教授便作為首席科技官創建了一個生物技術公司。再之后,他和他曾經的博士后合作導師雙雙當選為歐洲科學院院士。
有一句俗語叫“林子大了什么鳥都有”,對于種類龐大的微生物世界而言,這句話更是貼切。在組裝DNA這個方面,有些微生物本身的能力十分出眾,堪稱“出道即巔峰”,例如目前同源重組能力最為出色的酵母菌。
在酵母菌中進行DNA組裝的要求很簡單:只要兩段DNA之間有一定重疊的部分,酵母菌就可以利用它的能力將這兩個片段給連起來。2008年的一項實驗可算是對其同源重組能力最好的例證。
這項工作還是曾經人工合成支原體基因組的團隊所做的,令人矚目的是,他們將25個兩兩重疊、大小在17-35kb之間的DNA片段全部轉到酵母中,而酵母能一次性將這些片段連接成完整的基因組。
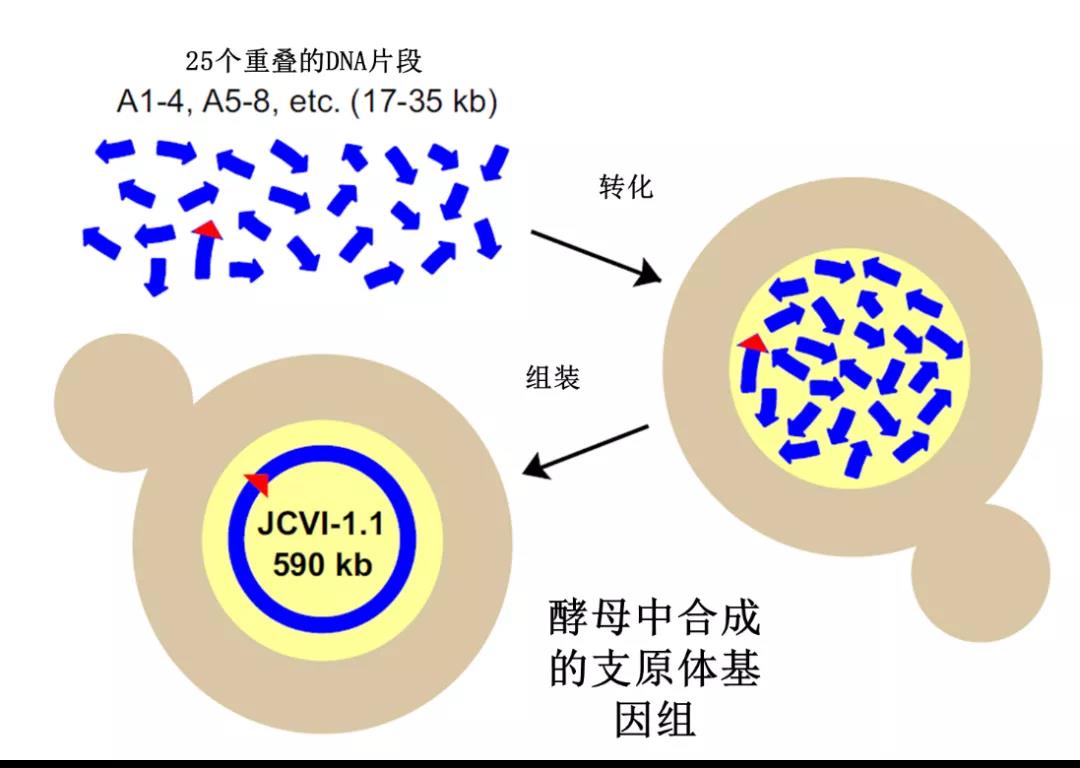
在酵母中組裝支原體的基因組(Gibson D G et al., 2008)
經過了幾十年的發展,目前生物工程師們已經具有了很強的將不同來源DNA組裝起來的能力。除解決實際問題之外,新技術的開發和迭代還能加速人類想象力邊界的拓寬。
那么,不妨也發揮一下你的想象:假如你現在擁有了組裝不同物種來源DNA的能力,對于跨越物種邊界的生命體,你有什么樣的奇思妙想和憂心之處?不妨在評論區告訴我們,我們會給你想法的可行性把把脈,解答你的疑惑和擔心。
參考文獻:
[1] Cohen S N, Chang A C Y, Boyer H W, et al. Construction of biologically functional bacterial plasmids in vitro[J]. Proceedings of the National Academy of Sciences, 1973, 70(11): 3240-3244.
[2] 克雷格 文特爾,生命的未來,浙江人民出版社,2016
[3] Gibson D G, Benders G A, Andrews-Pfannkoch C, et al. Complete chemical synthesis, assembly, and cloning of a Mycoplasma genitalium genome[J]. science, 2008, 319(5867): 1215-1220.
[4] Gibson D G, Young L, Chuang R Y, et al. Enzymatic assembly of DNA molecules up to several hundred kilobases[J]. Nature methods, 2009, 6(5): 343-345.
[5] Xia Y, Li K, Li J, et al. T5 exonuclease-dependent assembly offers a low-cost method for efficient cloning and site-directed mutagenesis[J]. Nucleic acids research, 2019, 47(3): e15-e15.
[6] Zhang Y, Buchholz F, Muyrers J P P, et al. A new logic for DNA engineering using recombination in Escherichia coli[J]. Nature genetics, 1998, 20(2): 123-128.
[7] Zhang Y, Muyrers J P P, Testa G, et al. DNA cloning by homologous recombination in Escherichia coli[J]. Nature biotechnology, 2000, 18(12): 1314-1317.
[8] Gibson D G, Benders G A, Axelrod K C, et al. One-step assembly in yeast of 25 overlapping DNA fragments to form a complete synthetic Mycoplasma genitalium genome[J]. Proceedings of the National Academy of Sciences, 2008, 105(51): 20404-20409.
策劃:李輝 呂雪峰
作者單位:中國科學院青島生物能源與過程研究所 微生物制造工程中心