黃酮是廣泛存在于植物中的一大類天然產物,如花青素、大豆異黃酮、水飛薊賓等,在功能性食品、醫藥等領域具有重要的應用價值。目前,黃酮資源依賴于植物中獲得,受制于植物種植周期長、組分多含量低、分離純化工藝復雜等諸多弊端,產能小、成本高,嚴重限制了黃酮類產品的應用開發和市場拓展。利用合成生物技術設計構建黃酮細胞工廠,推動植物黃酮的微生物高效生產成為一種重要解決方案。由于物種差異,植物黃酮合成途徑在微生物中異源重構面臨著適配性差、產量低等問題,距離商業化仍有較大差距。
近日,微生物制造工程中心在絲狀真菌中發現了黃酮生物合成基因簇(BGCs),通過合成途徑解析闡明了真菌黃酮合成新機制,豐富了對黃酮類化合物生物合成的認識,同時為合成生物技術開發提供了新的選擇(圖1)。相關研究成果發表在《德國應用化學》期刊上(Angew. Chem. Int. Ed. 2023, DOI: 10.1002/anie.202215529)。
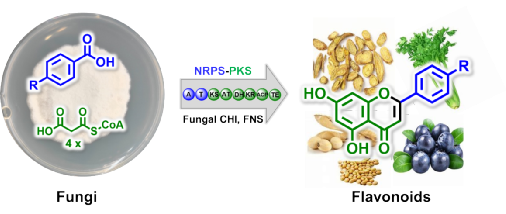
圖1. 真菌黃酮合成示意圖
利用自抗性基因共定位(SRGD)策略是開展天然產物基因組挖掘的一種有效方式,為了尋找具有抗菌和除草活性的天然產物,該團隊首先以合成支鏈氨基酸的關鍵酶乙酰乳酸合酶(ALS)為探針,在亮白曲霉中發現了負責合成黃酮類化合物氯黃酮的生物合成基因簇(圖2)。活性評價顯示氯黃酮具有抑制擬南芥種子萌發和抑制病原菌生長的活性,而體內和體外實驗也證實cfoL確實是編碼ALS的氯黃酮自抗性基因,因此具有開發成為除草劑和抗生素的潛力。
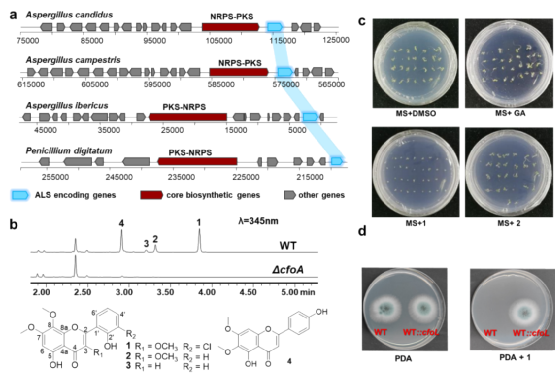
圖2. SRGD策略發現真菌氯黃酮合成基因簇及活性分析
植物黃酮的生物合成途徑目前已經研究清楚,首先是查耳酮合酶(CHS)III型PKS以對羥基肉桂酰輔酶A為起始單元與3分子乙酰輔酶A縮合形成查耳酮;然后在查耳酮異構酶(CHI)作用下形成黃烷酮,由黃酮合酶(FNS)進一步催化黃烷酮形成黃酮骨架;最后在修飾酶的作用下形成多種多樣的黃酮類化合物。本研究中通過基因敲除、同位素標記實驗發現亮白曲霉中查爾酮骨架由NRPS-PKS雜合酶CfoA以苯甲酸或對羥基苯甲酸為起始單元與4分子乙酰輔酶A縮合形成,而非是植物的III型PKS裝配模式,說明真菌黃酮骨架合成機制與植物存在顯著差異。
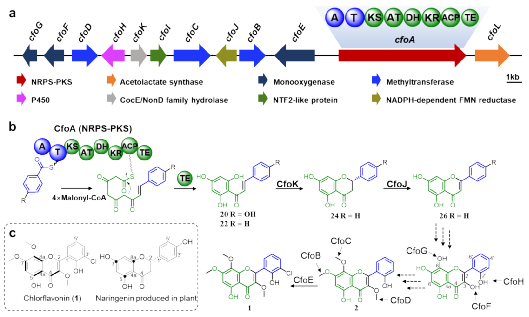
圖3. 亮白曲霉氯黃酮生物合成途徑
在此基礎上,通過基因敲除和體外酶活實驗發現CfoK催化查耳酮關環生成黃烷酮,這與植物中的CHI具有相同的功能。但是CfoK與目前已經發現的CHI存在不同的進化關系。基于AlphaFold2預測的蛋白質結構模擬和定點突變實驗表明CfoK通過His33介導的酸堿催化誘發查耳酮發生Oxa-Michael加成反應,以6-endo-trig關環方式形成構型專一的黃烷酮(圖4),這一機制不同于植物CHI中水介導的催化過程,因此CfoK是一種新穎的真菌查耳酮異構酶。
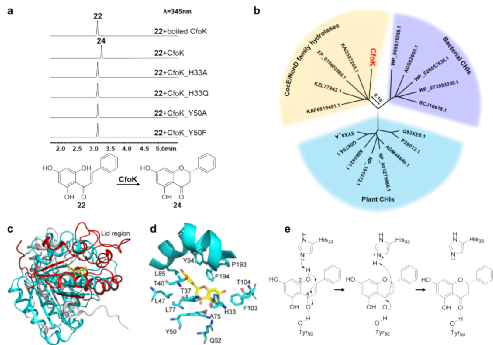
圖4. 真菌中查耳酮異構酶CfoK的表征
亮白曲霉中由黃素依賴型氧化還原酶CfoJ行使黃酮合酶(FNS)功能,將黃烷酮轉化為黃酮,進化樹分析顯示其與已知的FNS I (2-酮戊二酸依賴型雙加氧酶)和FNS II(細胞色素氧化酶P450)處于不同的分支。蛋白質結構預測和定點突變實驗結果顯示CfoJ是通過典型的黃素依賴型氧化還原酶催化機制介導C2-C3位的脫氫,將黃烷酮轉化為黃酮,這與植物FNS的自由基催化機制完全不同,因此CfoJ是一種新型的真菌黃酮合酶(圖5)。

圖5. 真菌中黃酮合酶CfoJ的表征
該研究完整解析了真菌黃酮獨特的生物合成途徑,提示真菌黃酮合成途徑在進化上是獨立的,而非通過基因水平轉移從植物中獲得。這一發現豐富了自然界黃酮生物合成的多樣性,同時也為其合成生物技術開發與微生物高效制造提供了新思路,因此對黃酮的應用價值開發具有重要意義。
微生物制造工程中心呂雪峰研究員和黃雪年研究員為本論文的共同通訊作者,博士研究生張偉為論文的第一作者,能源作物分子育種團隊付春祥研究員和吳振映副研究員參與了此項工作。本研究獲得了國家重點研發計劃、國家自然科學基金、山東省人才計劃及山東省重點研發計劃的支持。(文/圖 張偉,黃雪年)
Wei Zhang, Xuan Zhang, Dandan Feng, Yajing Liang, Zhenying Wu, Siyu Du, Yu Zhou, Ce Geng, Ping Men, Chunxiang Fu, Xuenian Huang*, Xuefeng Lu*. Discovery of a Unique Flavonoid Biosynthesis Mechanism in Fungi by Genome Mining.
Angew. Chem. Int. Ed.
2023, e202215529.